产品线涵盖分子生物、细胞培养、样品处理、微生物学、样品冻存、免疫检测、核酸提取、蛋白纯化、食品检测等方面,为客户提供品质产品及专业技术服务。
答:不推荐重复使用,不同样本之间容易造成污染。
抗体纯化磁珠
1.抗体纯化磁珠试剂盒是否可以重复使用?
答:不推荐重复使用,不同样本之间容易造成污染。
2.若体系中含有木瓜蛋白酶,是否影响磁珠的使用?
答:木瓜蛋白酶是一种蛋白水解酶,目前对protein A的影响未知,建议客户慎用。
3.1mL抗体纯化磁珠能够用多少次?
答:1mL磁珠能够结合1.5-2.0mg抗体,客户需要根据结合抗体的量来确定使用磁珠的量。
4.试剂盒中的缓冲液用完后,能否告知配方?
答:试剂盒中缓冲液的成分都是保密的。可以采用以下的缓冲液进行替代。
结合缓冲液:PBST
150mM PBS,150mM NaCl,0.1% (v/v) Tween-20,pH7.2
洗脱缓冲液:甘氨酸缓冲液
0.1M Glycine,0.1% (v/v) Tween-20,pH2.5(该缓冲液适合于耐酸性的抗体)。
0.1M Glycine,3M MgCl2 (4M protein A/G) ,0.1% (v/v) Tween-20,pH4.5(该溶液含较高浓度的盐,不可直接进行SDS-PAGE。可以用透析或超滤的方法去除过多的盐)。
保存缓冲液:
50mM Tris-HCl,0.1%(v/v) Tween-20,0.01%(w/v) NaN3,pH7.5
洗涤缓冲液:
50mM Tris-HCl,0.1%(v/v) Tween-20,pH7.5)
再生缓冲液:
1% (v/v) TritonX-100
His-tag蛋白纯化篇
1.蛋白不吸附或亲和力低
首先确认纯化前的样品中是否有目标蛋白。
(1)有目标蛋白,但大量穿透:
a、蛋白不含有标签或未能正确表达
解决措施:Western Blot鉴定目标蛋白是否有His-Tag。若没有,需要重新构建载体,添加组氨酸标签,并确认标签正确表达。
b、蛋白折叠导致组氨酸标签未完全暴露
解决措施:
在不变性条件下纯化蛋白,在样品和平衡缓冲缓冲液中加1-2M尿素,这样蛋白结构相对松散,而蛋白不会变性。
在变性条件下纯化蛋白,加入4~8M尿素或4~6M盐酸胍使蛋白变性。如果蛋白有二硫键,最好加1-2mM DTT或1~5mM巯基乙醇(在样品中添加),可以改善蛋白的吸附。
重新构建载体,将组氨酸标签换到另外一端,或在组氨酸标签基因与目的基因之间增加一段Linker,可以降低蛋白折叠后标签被掩盖的几率。
c、标签太短
解决措施:将标签的组氨酸数量增加至6-10个。
d、蛋白标签被水解
解决措施:添加合适的蛋白酶抑制剂;尽量在低温下处理样品;对于分泌表达的蛋白,长时间存放将增加蛋白被降解的风险,应尽快处理样品。
e、蛋白溶解度偏低或聚集
解决措施:在结合缓冲液中添加0.5%-1% Tween-20、Triton X-100,或5%~50%的甘油,可以增加蛋白的溶解度,减少蛋白聚集。
f、样品及结合缓冲液不合适
解决措施:确认样品及缓冲液中不含有EDTA、还原剂等。另外,将样品及结合缓冲液pH调节至7.4~8.5,有利于蛋白结合。
(2)有目标蛋白,但含量很低:
蛋白表达量低。解决措施:对样品进行浓缩,增加磁珠用量、延长反应时间;优化表达条件(诱导剂浓度、诱导温度、诱导时间,培养基等);或更换其他合适的表达载体或表达系统。
2.纯化得到的蛋白量少
(1)磁珠用量不足。本产品磁珠悬液浓度为10%,对于亲和力较高的蛋白,每毫升磁珠悬液可结合的蛋白量约为3~4mg。用户需要根据目标蛋白含量,使用足够量的磁珠。对于亲和力较低的蛋白,需要增加磁珠用量,延长反应时间,或提高样品及结合缓冲液pH。
(2)蛋白与磁珠亲和力较低。参考问题1。
(3)蛋白浓度低。对样品进行浓缩,或增加磁珠用量、延长反应时间。
(4)磁珠重复使用次数太多。将磁珠进行再生处理(参考产品说明书)。
3.洗脱产物杂带多什么原因?怎么处理?
(1)杂蛋白吸附。由于组氨酸,色氨酸,半胱氨酸等是蛋白质中很常见基团,而蛋白折叠可能导致几个这样的氨基酸残基临近,这样也会使它们和磁珠的作用力增加。可以用不同浓度的咪唑进行梯度洗脱,在样品及平衡缓冲液中添加0.5%吐温或Triton X-100,或5~50%的甘油,可以避免因为疏水相互作用导致非特异吸附,或使用钴离子螯合磁珠(BeaverbeadsTM IDA-Cobalt)。此外,要获得纯度较高的蛋白,需要对裂解、结合缓冲液、洗涤缓冲液、洗脱缓冲液的组分、pH、咪唑浓度等进行优化。若还是不能获得高纯度的蛋白,则需要考虑使用多步纯化,结合使用离子交换、凝聚过滤等纯化方法。
(2)菌体破碎条件太剧烈导致蛋白断裂。确保在冰浴条件下破碎;降低超声破碎的强度,缩短时间;适当稀释样品,添加核酸酶,降低样品粘稠度。
(3)蛋白被部分水解。添加合适的蛋白酶抑制剂,并尽可能在低温下操作。
4.目标蛋白难洗脱
穿透组分中目标蛋白明显减少,而洗脱组分中目标蛋白很少,取少量磁珠加SDS-PAGE Loadding Buffer于95℃加热5~10min,离心跑电泳,如果发现较多蛋白残留。
(1)洗脱调节太温和。提高洗脱液咪唑浓度至700mM还不能洗脱时,可以尝试降低洗脱液pH至4.0,但低pH会也导致金属离子脱落,磁珠需要再生后再使用。
(2)蛋白吸附在磁珠上无法洗脱。对于非特异性疏水吸附的蛋白,可以增加NaCl浓度至1M,或添加0.1%~2%的Triton X-100洗脱。对于聚集沉淀在磁珠上的蛋白(尤其注意含有二硫键的蛋白),可以在洗脱缓冲液中加入6M盐酸胍进行变性洗脱。
5.磁珠再生后,蛋白纯化效果变差怎样改善?
(1)再生过程的碱处理可以改善再生磁珠的蛋白纯化效果,参考海狸生物医学《组氨酸标签蛋白纯化试剂盒》说明书中磁珠再生部分步骤4。
(2)重新挂金属离子后为清洗干净,需要增加洗涤步骤。残留的金属离子优先跟蛋白结合,影响蛋白与磁珠的结合。
6.缓冲液中咪唑添加的意义
(1)结合缓冲液中低浓度的咪唑是为了减少杂蛋白的非特异性吸附;
(2)洗涤缓冲液中低浓度咪唑是为了吸取吸附能力较弱的杂蛋白;
(3)洗脱液中高浓度咪唑是为了洗脱目的蛋白。
7.IDA-镍和IDA-钴的区别
IDA-镍的蛋白载量高,40mg/mLgel,纯度稍低,纯度有90%。
IDA-钴的蛋白载量稍低,25mg/mLgel,纯度达到95%。
一般客户建议购买IDA-镍磁珠,即可达到目的。
GST融合蛋白纯化篇
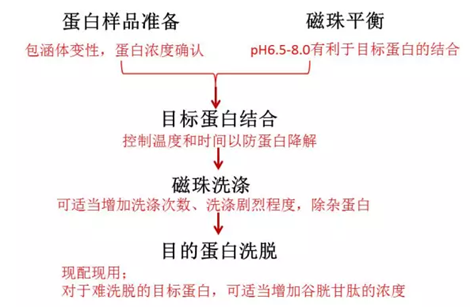
1.如何纯化GST融合蛋白?
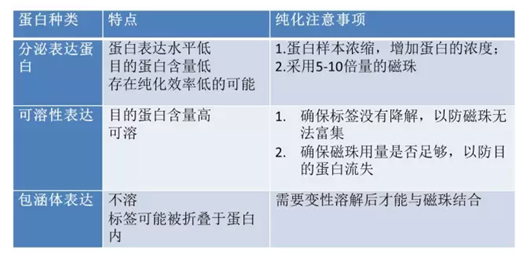
2.可纯化蛋白种类
3.磁珠挂不上目的蛋白
以下的处理方案的前提是样本里面有目的蛋白,如果是包涵体需要变性。
可能一:结合条件不对
理想的结合条件为pH 6.5-8.0,纯化之前确认磁珠是否采用缓冲液平衡以及蛋白样本的pH值,低于pH6.5或高于pH8时,融合蛋白与磁珠结合不充分导致结合效率低。
可能二:样本中目的蛋白的浓度偏低
目的蛋白的浓度过低,会严重影响磁珠与蛋白的结合。
两种方法可供选择:
a)浓缩蛋白样本;b)增加磁珠的浓度
可能三:检查目的蛋白是否聚集沉淀
在细胞裂解前加入DTT,在缓冲液中也加入DTT 。1-20mM的DTT 会显著增加某些GST融合蛋白的结合。
可能四:判断是否是因为GST失活
过度超声会破坏标签蛋白而减少其与磁珠的结合。减少超声破碎的时间和强度。
可能五:标签蛋白可能改变了GST 构相
降低结合的温度来改善结果。
4.目的蛋白在磁珠上,洗脱不下来
第一步:判断是否结合
取Mag beads加loading buffe煮沸,再跑page电泳。
如果确认有蛋白,且载量还很高,那么极有可能是形成了过蛋白沉积。
太多的蛋白沉积在磁珠孔内,无法洗脱。建议将目的蛋白样本稀释,少量纯化。
第二步:调节洗脱条件
洗脱缓冲液pH,酸性的都洗不下蛋白。尽量将洗脱液的pH值调到8.0。
5.洗脱样本里面有杂蛋白
可能一:非特异性吸附
提高平衡缓冲液中的盐浓度可以降低因为离子作用带来的非特异吸附。
在平衡缓冲液中添加0.5%吐温或Triton可以避免因为疏水相互作用导致非特异吸附,这些措施都可以电泳的杂带明显减少。
可能二:26KD的GST条带
GST融合蛋白的表达系统很容易表达到GST部分就终止,所以26KD左右的杂带是很常见的,那可以选择用不同浓度的还原谷胱甘肽去做阶段洗脱,如果还是分不开,那也许就得选择离子交换或者凝胶过滤等别的分离手段。
可能三:蛋白降解
如果用上述方法还是杂带多,那就地回头去看看破碎的条件是不是太剧烈或者温度控制不好导致蛋白短裂或者分解导致一些蛋白片段带标签,或者因为样品长时间保存导致水解等
可能四:蛋白相互作用
蛋白相互作用形成聚合体,导致杂带增加,而由于疏水相互作用或者因为离子作用可以通过添加表面活性剂或者增加离子强度得到改善,对于因为形成聚合体的可以在缓冲液和样品中加1-2mM巯基乙醇避免。
Strep-tag II磁珠
海狸Strep-tag II磁珠可以在生理条件下纯化得到使Strep-tag融合蛋白。与其他tag相比,这些温和的纯化参数能保存蛋白质的生物活性,并仅经一步层析后即可产出超过99%的纯度。
1.Strep-tagII磁珠纯化的技术原理是什么呢?
答:主要基于Strep –tagII多肽与Strep-Tactin(一种经过特殊工艺改造的链酶亲和素)的相互作用,在生理缓冲液或是含有其他添加剂的环境下,带有标签的蛋白与固定化的Strep Tactin亲和纯化,经过加有2.5mM脱硫生物素的同种缓冲溶液中即可温和地将纯化的重组蛋白洗脱下来。 这些温和的纯化参数能保存蛋白质的生物活性,并可获得纯度超过99%的目标蛋白。
2.Strep-tagII的分子量大约是多少?通常在融合蛋白的什么位置?
答:Strep-tagII多肽有8个氨基酸( Trp-Ser-His-Pro-Gln-Phe-Glu-Lys)分子量约为1KDa.作为标签可以在蛋白的N端或是C端,也可以作为两个蛋白域的链接,甚至可以用于换种结构中。
3.Strep-tag磁珠的载量如何呢?
答:海狸纳米磁珠蛋白结合量可以达到7mg Strep-tag II蛋白 /mL Gel
4.纯化蛋白的纯度如何?
答:纯度>95%。但是如果存在重组蛋白非特异性互作就可能降低蛋白纯度。为了减少污染,可以再结合洗涤和洗脱时加入合适的添加剂(如还原剂,盐,温和的去污剂)。如果是二硫键共价结合的杂蛋白,可以在缓冲液中加入还原剂。非共价键结合一般采用提高离子强度的方法,常用NaCl或Triton X-100,Tween20和CHAPS等。
5.Strep-tagII磁珠结合抗生素的蛋白吗?
答: 不会。
6.洗脱下来的蛋白质混有脱硫生物素吗?
答:没有,脱硫生物素不会与蛋白结合货干扰蛋白分析,而且容易通过透析或是过滤去除。
- 暂无相关记录!
周一至周五:9:00—18:00
周六、周日:9:00—16:00









